
L'épreuve de sciences physiques comprend des exercices de physique (notés sur 11) et de chimie (notés sur 9). Tous les exercices sont obligatoires et indépendants les uns des autres. Le candidat répond sur la feuille en écrivant sur les lignes réservées à cet effet ou en dessinant des schémas.
Exercices de physique (sur 11 points) :
I- Electricité
Le circuit R, L, C schématisé ci-dessous est alimenté par un générateur basse fréquence (GBF) délivrant une tension sinusoïdale. On réalise les connexions représentées sur le schéma entre le circuit et un oscilloscope. On obtient sur l'écran les courbes ci-dessous.

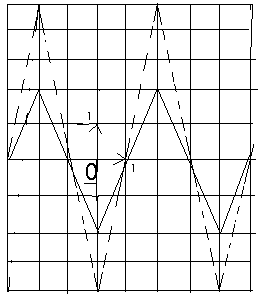 |
Durée de balayage : 0,1 ms /div Sensibilité verticale : Voie A (dessinée en traits pleins) : 1 V/div Voie B (dessinée en pointillés) : 0,5 V /div Ampèremètre utilisé en alternatif indique I = 7 mA
|
1- Quelle est la période de la tension délivrée par le GBF ? En déduire sa fréquence :
2- Quelles sont les tensions mesurées en voie A et en voie B ? En déduire la valeur maximale de la tension délivrée par le GBF :
3- On peut dire que "la voie A permet de visualiser l'intensité". Expliquer pourquoi ?
4- Quelle est la valeur de la résistance R ? Justifier votre réponse.
5- Quel est le déphasage entre la tension délivrée par le GBF et l'intensité du courant dans le circuit? Que peut-on dire alors du circuit R L C ?
II- Electronique
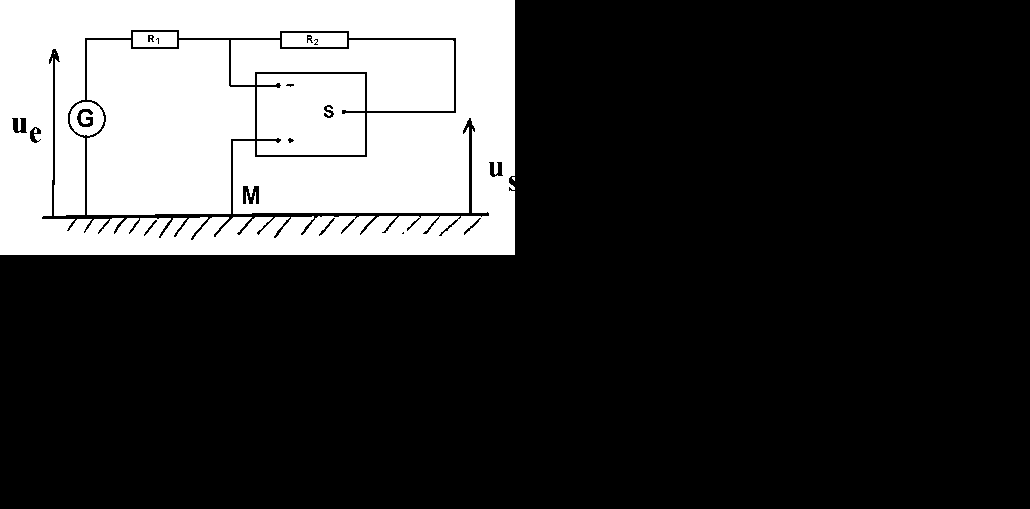
On réalise le montage ci-contre avec R1= 1 k![]() ( (fig 1)
( (fig 1)
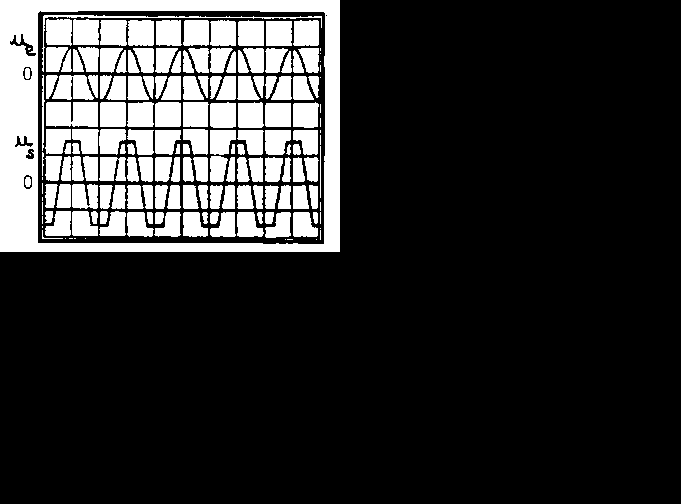
La tension ue délivrée est sinusoïdale. Elle s'écrit ue=Uesin(t ave Ue= 5 V.
La tension us également sinusoïdale et s'écrit us=-Ussin(t ave Us= 10 V.
1- De quel type de montage s'agit-il ? Expliquer le signe - dans l'expression de us
2- Définir puis calculer l'amplification et le gain (en dB) du montage
3- Démontrer l'expression de l'amplification en fonction des valeurs de résistances R1 etR2. En déduire la valeur de la résistance R2.
4- On augmente la tension d'entrée ue, on obtient une tension de sortie us "écrétée". Donner la valeur de la tension de crête ? Expliquer ce phénomène (voir fig 2)
III- Stroboscopie
Un disque blanc, portant un secteur noir, tourne d'un mouvement périodique de fréquence N que l'on souhaite déterminer. Un stroboscope électronique éclaire le disque. La fréquence des éclairs vaut Ne.
A partir de 150 Hz on diminue la fréquence Ne des éclairs. On observe l'immobilité apparente pour la première fois à la fréquence Ne=60 Hz d'un secteur noir unique .
En déduire la fréquence de rotation du disque puis sa vitesse en tours par minutes
Décrire les phénomènes observés pour les fréquences stroboscopiques suivantes (justifier avec soin les réponses)
pour
Ne = 30 Hz ...........................................................................................................
Ne = 20 Hz ...........................................................................................................
Ne= 120 Hz ...........................................................................................................
Ne = 59 Hz ...........................................................................................................
Ne = 61 Hz ...........................................................................................................
IV- Optique géométrique
1- Que signifie l'indication +5 que l'on peut lire sur la monture d'une lentille? Préciser l'inité
2- Calculer sa distance focale. Préciser la formule utilisée et l'unité
Pour déterminer expérimentalement la distance focale d'une lentille, on utilise un banc d'optique portant :
- un objet lumineux de 4 cm, noté AB
- une lentille L
- un écran E
L'objet source étant fixe, on déplace la lentille et l"écran de façon à obtenir sur l'écran une image nette de même grandeur que l'objet
3- Dessiner un schéma de l'expérience
Quelle est la nature et l'orientation de l'image obtenue ?
Quelle est la position de la lentille par rapport à l'objet et à l'écran ?
Justifier la réponse précédente à partir de l'expression du grandissement
La distance objet-lentille est 40,2 cm. En déduire la distance focale de cette lentille
Justifier la réponse précédente à partir de la formule des lentilles
Exercices de chimie (sur 9 points)
I- Nomenclature
1- Nommer les corps suivants
a) Na2S2O3................................................ ; b) K2Cr2O7 .................................................................
2- Ecrire les formules semi-développées des composés organiques :
a) propanal ..............................................................c) éthanamide (ou acétamide) ..................................
b) acide butanoïque .................................................d) anhydride phtalique : ...............................................
II- Chimie organique
On dispose du matériel suivant :
- éprouvette graduée de 50 mL, 100 mL et 250 mL
- fioles jaugées de 50 mL, 100 mL, 250 mL, 500 mL et 1 L
- burettes de Mohr de 25 mL et 50 mL
- pipettes jaugées 5 mL, 10 mL, 20 mL, 25 mL et 50 mL
- béchers de 50 mL, 100mL, 250 mL
- erlenmeyers
- verres à pied
- poires aspirantes
- pissette d'eau déminéralisée
- Agitateur magnétique et barreau magnétique
- ballons de 50 mL, 100 mL, 250 mL
- réfrigérant
- chauffe-ballon
On veut réaliser l'hydrolyse d'un ester : l'éthanoate (ou acétate) d'éthyle (CH3CO2C2H5) à partir d'un mélange de 0,5 mol d'ester et 0,5 mol d'eau placées dans un ballon.
1- Quels volumes d'ester et d'eau faut-il prélever pour préparer le mélange initial ?
Justifier votre calcul
Données :
- masses volumiques µeau = 1 g/cm3, µester = 0,9g/cm3 masses molaires atomiques MH = 1,0 g.mol-1 ; MO = 16,0 g.mol-1 ; MC = 12,0 g.mol-1
2- Ecrire l'équation-bilan de la réaction d'hydrolyse en utilisant les formules semi-développées et nommer les produits formés 3- Comment s'appelle la réaction inverse qui a lieu en même temps ?
4- Quel catalyseur peut-on utiliser ?
5- Au bout de 24 heures, on veut déterminer la quantité (en mol) d'acide carboxylique formé. A cet effet on prélève 5 mL du mélange du ballon et on les dose avec de la soude de concentration 1,0 mol.L-1.
5-1 Décrire à l'aide de schéma le mode opératoire du dosage réalisé en précisant le nom de la verrerie et des réactifs utilisés
5-2 Parmi les trois indicateurs colorés suivants entourer celui qui est le mieux adapté pour repérer l'équivalence acido-basique. Justifier votre réponse
- hélianthine zone de virage 3,1-4,4
- bleu de bromothymol zone de virage 6,0-7,6
- phénolphtaléine zone de virage 8,2-10
6- La solution de soude utilisée de concentration, a été préparée par dissolution dans l'eau de soude en cristaux (NaOH)
Quelle masse de soude a-t-il fallu dissoudre pour préparer 500 cm3 de cette solution ?
Données masses molaires atomiques MNa = 23 g.mol-1 ; MH = 1,0 g.mol-1 ; MO = 16,0 g.mol-1 ;
7- A partir de la soude à 1,0 mol.L-1 , le préparateur doit préparer pour une autre expérience 100 cm3 de solution de soude de concentration 0,1 mol.L-1
Décrire le mode opératoire à l'aide de schémas en indiquant précisément le matériel utiliei (noms ; volumes...)
III- OXYDO-REDUCTION
1- Donner la définition (électronique)
- d'un oxydant : .....................................................................................
- d'un réducteur : .....................................................................................
2- Dans les deux couples oxydoréducteur suivants Cu2+ / Cu et Zn2+ / Zn indiquer
- le(s) oxydant(s) : .........................................................................
- le(s) réducteur(s) : ........................................................................
3- L'oxydant du couple Cu2+ / Cu a un pouvoir oxydant supérieur à celui de l'oxydant du couple Zn2+ / Zn Que se passera-t-il si :
- on place une lame de zinc dans une solution contenant des ions Cu2+ ?
.......................................................................................................................................................
- on place une lame de cuivre dans une solution contenant des ions Zn2+
.............................................................................................................................................................
4- On réalise une pile DANIELL avec les deux couples précédents
4-1 Faire un scéma pour expliquer sa réalisation
4-2 Indiquer le pôle + de cette pile sur le schéma
4-3 Avec quel appareil peut on mesurer précisément la fem de cette pile. Préciser la caractéristique de cet appareil ainsi que les branchements à réaliser
5- On donne la classification électrochimique de quelques couples oxydoréducteurs avec les potentiels d'oxydoréduction standard E°
| Couple rédox | E° (V) |
| Ag+ / Ag Cu2+ / Cu H3O+ / H2 Zn2+ / Zn |
0,96 0,34 0,00 -0,76 |
5-1 Calculer la fem de la pile Daniell. Justifier votre réponse
5-2 Le métal argent peut-il être attaqué par l'acide chlorhydrique. Justifier
5-3 Ecrire l'équation-bilan de la réaction qui se produit quand la pile fonctionne